警察官のメタンフェタミンへの曝露と慢性疾患:解毒療法による著しい改善
要旨
要約
背景:医学文献は、法執行機関職員のメタンフェタミンおよび関連化学物質への反復暴露による健康被害を報告している。 ほとんどの影響は一過性のものであるが、ユタ州の何人かの警察官は職務に関連してメタンフェタミンに暴露した結果、慢性疾患が発症し、その一部は身体障害を誘発した。 本報告書は、症状を有する警察官に対し慢性症状の軽減と生活の質(QOL)の向上を目的として計画された、サウナを使用した解毒プロトコルによる治療のカルテについて、制限を加えることなく、遡及的に評価を行ったものである。 方法:ユタ州メタンフェタミン警察官プロジェクト(Utah Meth Cops Project)に参加した92人の警察官に対し、段階的な運動と包括的な栄養補給、および身体的なサウナ療法を含む治療プログラムの前後で評価が行われた。 評価には、ランド研究所(RAND)の36問短答式健康調査票(SF-36)の治療前後のスコアとRAND標準値との比較、治療前後の症状スコア強度、神経毒性スコア、ミニ・メンタル・ステート検査(Mini-Mental State Examination)、主症状の頻度、および治療プログラムに関する安全性の体系化された評価が含められた。 結果:SF-36の評価、症状のスコア、および神経毒性スコアにおいて統計的に有意な健康改善が認められた。 本解毒プロトコルは、92.8%の完遂率という良好な忍容性を示した。 結論:本調査は、サウナと栄養療法の活用がメタンフェタミンに関連する法執行活動に伴う化学物質への暴露後に現れる慢性症状を緩和する可能性があることを強く示唆している。 本報告書は、その他の複合的化学物質への暴露による明らかな有害作用に対処することにも関連性がある。 本グループにおける肯定的な臨床的成果を鑑み、このサウナを使用した治療法の広範な調査が支持されるものと思われる。
はじめに
メタンフェタミン中毒者は深刻な健康問題を抱えるようになるが、メタンフェタミンの違法製造の現場捜査に従事した法執行機関職員の多くがそれに伴う重篤な症状を経験しているという事実はあまり理解されていない(CDC、2005年)。 症状は一過性のものとはいえ、多くの個人が医師の診察を必要とする持続性の症状を有している。
活発な製造現場への対応は、化学物質への暴露の度合いが低いと思われる活動と比較し、健康を損なう危険性を7倍から15倍上昇させていた。 マーシャル(2000年)によれば、1993年以降「違法薬物製造現場への捜査数は増加し続け、ユタ州は一人当たりのメタンフェタミン製造工場の数において最高の州となった」。
2007年、ユタ州検事総長がサウナを使用した解毒法を調査した。この解毒法は、2001年9月11日のワールド・トレード・センターの攻撃と崩壊の場に立会い、慢性疾患に苦しむ救助隊員と復旧作業員の治療のためにマンハッタンで実施されたものである。 ユタ州においてメタンフェタミン製造現場に関連した暴露後、健康を損ねた警察高官と消防士は、この治療を受けた後に大幅な健康改善を示した。
非営利のアメリカン解毒財団(American Detoxification Foundation、ADF)はユタ州メタンフェタミン警察官プロジェクト(UMCP)を立ち上げ、運営した。本プロジェクトでは、メタンフェタミンと関連薬物への職務上の暴露に共通して見られる(およびその後発症した)症状に対処することを目的とし、ユタ州の警察官に対しハバード式解毒プロトコルが使用され、健康状態とQOLが検査された。
方法論
試験対象の概要、選定基準および除外基準
本論文は、2007年10月から2010年7月の間に連続してUMCPに参加した最初の69人の警察官のカルテを遡及的に評価したものである。 警察官は、プロジェクト・スタッフのアウトリーチの努力、警察官コミュニティ内での口伝え、および警察本部長や郡保安官の紹介によって招集された。
除外基準:妊娠、がん患者、車椅子生活、精神病歴、大規模な精神科治療、もしくは自殺未遂が除外基準であった。
選定基準:(1)ユタ州内の法執行機関業務に従事し、(2)業務執行中のメタンフェタミンおよび関連化学物質との接触が記録されており、(3)その後、持続性の医学的症状または慢性疾患を発症した者が選定基準であった。 警察官は、治療と成果のモニタリングに同意する書面によるインフォームド・コンセントを提出した。その同意には、集約された知見が報告されることも含まれる。
参加者は、その全般的経歴、身体検査、EKG、および血液分析(代謝パネルおよび肝臓パネル、B型肝炎、C型肝炎およびHIV検査、全血球数、甲状腺パネル)によって、医療責任者が選出した。 直接の質疑の結果、評価を要する問題が明らかになった場合、テストステロン・レベルを含む追加のテストが行われた。 衰弱性の症状を示した警察官は優先され、メタンフェタミンに関連する暴露の回数、年齢、性別、または職位によって治療が優遇されることはなかった。
患者には、ユタ州の多くの都心部および郡区域の覆面捜査官、麻薬捜査官、特別機動隊(SWAT)の隊員、ユタ州ハイウェイ・パトロール(UHP)、入国税関管理局(ICE)、麻薬取締局(DEA)関連の職員、および薬物製造現場の分析実施期間中に暴露した職員が含まれていた。
治療介入: 標準的なハバード式サウナ解毒プロトコル (ハバード 1990)
治療成果の評価
基準となる病歴、身体検査、経過観察のための面談、および治療前後の一連の評価を使用し、症状の変化とQOLが評価された。
- 36問短答式RAND健康調査票(SF-36)によって、治療前の4週間にわたる健康に関連したQOLが評価された。 RAND SF-36のスコア化の仕組みは、メディカル・アウトカム・トラストが認可しているものと異なり、機能的能力と心身の健康が9項目の側面に分けられた。 また、SF-36スコアは治療前後、および米国のRAND成年標準値と比較された。
- ハバード方式を使用した臨床条件に合わせ、治療前後に行う50項目の調査票が科学教育振興財団(FASE)によって開発された。この調査票では、記入日より前の4週間における症状、病気の日、睡眠パターンが調査された。
- シンガー(2006年)のパラメータに基づく13項目の治療前後の神経毒性に関する調査票では、記入日より前の3週間における被刺激性、引きこもり、意欲の低下、近時記憶、集中力、思考遅延、睡眠障害、疲労、頭痛の頻度と重症度、性的機能不全、四肢のしびれ感、思考の明晰さの低下を含む問題の評価が0から10のリッカート尺度で表現された。
- ミニ・メンタル・ステート検査
- 日報:訓練を受けたスタッフによって記録された治療日毎の(治療との関係の有無にかかわらず)望ましくない効果を含む重要な徴候や事象を体系的にまとめたもの。
安全性評価のため、有害事象やプロトコルの中断はいずれも日報に記載され、医療責任者によって査定された。
成果
治療期間と完遂率
合計66名の男性および3名の女性(平均年齢44.6歳)が順次参加し、完遂率は92.8%であった。5名の男性が治療を完了しなかった。 治療を完了した64名の平均治療期間は33日であった。
開始時点において参加者の50%超に認められた症状には、疲労:96%、不眠症:91%、頭痛:90%、胸焼け:81%、性格の変化:78%、両手および/または両足のしびれ感:77%、記憶障害:77%、アレルギー既往歴:75%、集中力の低下:75%、腰痛:71%、関節痛:71%、労作時の息切れ:70%、皮膚炎:68%、不安/鬱:65%、腹部ガス/腹痛:65%、副鼻腔炎/痰の詰まり:55%、および咽頭痛:52%が含まれていた。
開始時点において異常が認められた参加者の割合は、血中脂質の上昇:58%、肝機能検査値の上昇:41%、ロンベルグ徴候陽性(目を閉じた閉脚直立状態においてバランスを保つことができない状態):35%、高血圧:28%、高血糖:19%、低血中テストステロン濃度:17%、および低血中甲状腺ホルモン濃度:17%であった。
治療法の安全性
不快感または「有害事象」(この表現は、感情的または病的な症状を有することを意味する)は、プログラムの提供に対する著しい妨げとはならなかった。 例えば、参加者全員がナイアシンによって一般的に引き起こされる一過性の潮紅や掻痒(そうよう)を経験したが、それがプログラムの提供および参加者がプログラムを完了する上での妨げとなることはなかった。 表2が示す通り、多くの参加者が気分の落ち込み、瞬間的咳(せき)、疲労などの一時的な作用を経験した。 これらはすべて一過性のものであり、診療を必要とすることはなかった。 不眠によってプログラムの提供が変更される場合があった。 十分な睡眠が取られなかった翌日のプログラムは、低減された。 2名の参加者は痛風を発症し、その内1名はプログラムを中断した。
RAND SF-36スコア:
健康に関連したQOLの変化
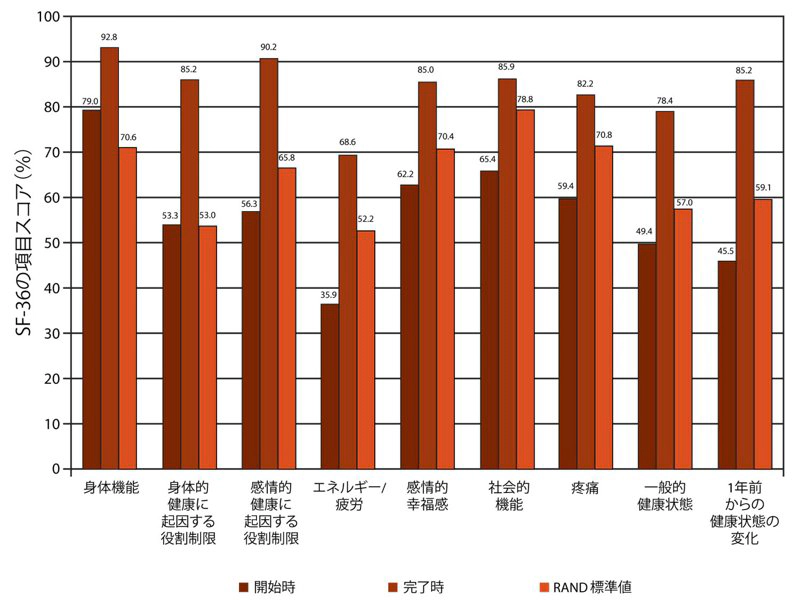
本プログラムを完了した参加者の治療前後のSF-36の平均スコア(RAND方式を用いて計算された)を図2に示し、米国の標準値と比較した。
参加者の治療前の健康に関連したQOLスコアは、9項目の内、「身体機能」および「身体的健康に起因する役割制限」を除く全項目においてRAND標準値と比較し有意に低かった。 治療後の参加者のスコアは、治療前のスコアと比較し、統計的に有意な改善を示した。 また参加者の治療後のスコアは、RAND標準値と比較し、すべての項目において有意な改善を示した。
症状の重症度および健康不良であった日数
治療前後の症状の重症度を示す平均的スコアが図3に示されており、治療前に対し治療後のスコアが有意に低下している。
患者は平均的に以下のように報告した。
- 身体的に健康不良の日数は、治療前の9.3日から完了までに1.8日に改善。
- 心的に健康不良の日数は、治療前の6.3日に対し、完了までに1.4日。
- 健康不良のために活動が制限された日数は、治療前の4.3日に対し、完了までに0.2日。
- 病気の日数は、治療前の2.0日に対し、完了までに0.3日。
睡眠パターン
参加者の治療前の平均睡眠時間は5.8時間であったが、完了時点において7.6時間に改善された。
神経毒性スコア
この調査は20番目の参加者から実施された。 不完全なデータを除き、治療前後が両方得られた回答が38件得られた(回答率84%)。 治療前の神経毒性スコアの平均値は65.5であったが、治療後の平均値は14.6であった。
ミニ・メンタル・ステート評価
30点満点において、25点未満のスコアは顕著な認知機能障害を示す。 治療前後の平均スコアの比較において、測定可能な変化は認められなかった。
討論
警察官は一般に、強健な身体的資質と安定した精神を必要とする。 職業適性の基準とは対照的に、このプロジェクトにおいて治療された警察官は、化学物資への暴露に伴う慢性的な衰弱性の症状を有していた。
69名の小規模なグループにおいて患者の17%から成る2つの小グループが低甲状腺ホルモン濃度、および/または低テストステロン濃度を示したことは驚くべきことであった。 米国における甲状腺機能低下症の有病率は約5%である。 既存の甲状腺ホルモンのバランスの崩れが彼らの慢性病の素因となる場合もあるが、環境中の化学物質と甲状腺機能低下との間の因果関係を考慮すると、甲状腺ホルモンの低下はメタンフェタミンに関連する暴露の直接的な結果であった可能性がある。
また、慢性的な健康障害を報告した参加者の間で共通する症状は独特のものであった。 75%を超える参加者が9種の症状(疲労、不眠症、頭痛、胸焼け、性格の変化、両手および/または両足のしびれ感、記憶障害、アレルギー症状の既往歴、集中力の低下)のすべてを報告した。 この症候群は「共通する暴露」が「共通する症状」を引き起こした可能性を浮き彫りにする。 この症状のパターンは、今後の研究者や施術者がメタンフェタミンに関連する暴露を識別、あるいは分類する手助けとなる可能性がある。 メタンフェタミンに暴露した参加者の/D/治療前の//SF-36スコアは、一般の人より強い痛み、疲労、および著しい健康障害の徴候を示した。
このような背景において、ハバード式サウナ治療プロトコルが活用された。 化学物質の暴露および/または汚染がこれらの慢性症状を引き起こしたのであれば、多面的な「解毒プログラム」は合理的な取り組み方であったということである。
我々の知る限り、サウナを使用した「解毒プログラム」がメタンフェタミンに暴露した警察官において評価されたのは、今回が初めてである。 参加者の大多数が不快感や不都合を最小限に留め、本治療法を完了し、その症状が有意に軽減され、健康とQOLが測定可能な程度まで改善された。 これは、本プログラムが同様の暴露を経験した他の場所の警察官の助けとなる可能性があることを示唆する。
| 事象を経験した人数 | 事象により欠席した人数 | 事象により医師の診療を必要とした人数 | 事象によりプログラムを中断した人数 | ||||||
| ナイアシン・フラッシュ (潮紅)、皮膚の掻痒 | 69 | 0 | 0 | 0 | |||||
| 感情的、被刺激的、 落ち込み | 18 | 0 | 0 | 0 | |||||
| 咳、痰の詰まり、 咽頭痛 | 13 | 0 | 0 | 0 | |||||
| 発熱を伴わないイン フルエンザ様の症状 | 11 | 0 | 0 | 0 | |||||
| 微熱を伴うイン フルエンザ様の症状 | 2 | 0 | 0 | 0 | |||||
| 頭痛 | 6 | 0 | 0 | 0 | |||||
| 不眠、 鮮明な夢 | 15 | 12a | 0 | 1b | |||||
| 疲労 | 14 | 0 | 0 | 0 | |||||
| 胃痙攣、 (おしん)悪心、下痢 | 8 | 3 | 0 | 0 | |||||
| 身体の痛み | 5 | 2 | 0 | 0 | |||||
| 痛風 | 2c | 2 | 1 | 1 | |||||
| 仕事などとの予定の重複 | 5 | 4 | 0 | 3d | |||||
|
aプロトコルにつき、睡眠時間が6.5時間未満の患者は翌日の治療が短縮され、運動が10分、10分のサウナ時間が4回(それぞれの間に10分の休憩)とされた。 bこの患者は実質的な健康の改善を報告したが、プログラム期間を通して睡眠が不足していた。 全データの分析を目的とするため、治療は未完了と見なされる。 cいずれの患者も、プログラムの開始前に痛風が発症したことを報告した。 d2名の参加者が治療に十分な時間を充てず、仕事に戻らなければならなかった。3人目は業務関連の要因により中断、またプログラムの途中で6日欠席した。 |
|||||||||
参照文献:
- Alexson O, Hogstedt C (1994) The health effects of solvents. In: Zenz C, Dickerson OB, and Horvath EP (eds) Occupational Medicine. St. Louis: Mosby Press, 764–768.
- Betsinger G (2006) Coping with meth lab hazards. Occupational Health and Safety 75(11): 50, 52, 54–58.
- Burgess JL (2001) Phosphine exposure from a methamphetamine laboratory investigation. Journal of Toxicology Clinical Toxicology 39(2): 165–168.
- Burgess JL, Barnhart S, and Checkoway H (1996) Investigating clandestine drug laboratories: adverse medical effects in law enforcement personnel. American Journal of Industrial Medicine 30(4): 488–494.
- Burgess JL, Kovalchick DF, Siegel EM, Hysong TA, and McCurdy SA (2002) Medical surveillance of clandestine drug laboratory investigators. Journal of Occupational and Environmental Medicine 44(2): 184–189.
- Carpenter DO, Arcaro K, and Spink DC (2002) Understanding the human health effects of chemical mixtures. Environmental Health Perspective 110(suppl 1): 25–42.
- CDC (2000) Public health consequences among first responders to emergency events associated with illicit methamphetamine laboratories—selected states, 1996–1999. MMWR Morbidity and Mortality Weekly Report 49(45): 1021–1024.
- CDC (2003) Recognition of illness associated with exposure to chemical agents—United States, 2003. MMWR Morbidity and Mortality Weekly Report 52(39): 938–940.
- CDC (2005) Acute public health consequences of methamphetamine laboratories—16 states, January 2000–June 2004. MMWR Morbidity and Mortality Weekly Report 54(14): 356–359.
- Cecchini M, LoPresti V (2007) Drug residues store in the body following cessation of use: impacts on neuroendocrine balance and behavior—use of the Hubbard sauna regimen to remove toxins and restore health. Medical Hypotheses 68(4): 868–879.
- Cecchini MA, Root DE, Rachunow JR, and Gelb PM (2006) Chemical exposures at the World Trade Center: use of the Hubbard sauna detoxification regimen to remove toxins and restore health. Townsend Letter 273: 58–65.
- Crinnion W (2007) Components of practical clinical detox programs—sauna as a therapeutic tool. Alternative Therapies in Health and Medicine 13(2): S154–S156.
- Dahlgren J, Cecchini M, Takhar H, and Paepke O (2007) Persistent organic pollutants in 9/11 World Trade Center rescue workers: reduction following detoxification. Chemosphere 69(8): 1320–1325.
- EHP Forum (1998) The threat of meth. Environmental Health Perspectives 106: A172–A173.
- Folstein MF, Folstein SE, and McHugh PR (1975) ‘‘Mini-mental state’’. A practical method for grading the cognitive state of patients for the clinician. Journal of Psychiatric Research 12(3): 189–198.
- Garwood ER, Bekele W, McCulloch CE, and Christine CW (2006) Amphetamine exposure is elevated in Parkinson’s disease. Neurotoxicology 27(6): 1003–1006.
- Hall HV, McPherson SB, Twemlow SW, and Yudko E (2003) Epidemiology. In: Yudko E, Hall HV, and McPherson SB (eds) Methamphetamine Use: Clinical and Forensic Aspects. Boca Raton: CRC Press, 13–15.
- Hays RD, Sherbourne CD, and Mazel RM (1993) The RAND 36-Item Health Survey 1.0. Health Economics 2(3): 217–227.
- Herpin G, Gargouri I, Gauchard GC, Nisse C, and Khadhraoui M, Elleuch B, et al. (2009) Effect of chronic and subchronic organic solvents exposure on balance control of workers in plant manufacturing adhesive materials. Neurotoxicity Research 15(2): 179–186.
- Hollowell JG, Staehling NW, and Flanders WD, Hannon WH, Gunter EW, Spencer CA, et al. (2002) Serum TSH, T(4), and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). The Journal of Clinical Endocrinology and Metabolism 87(2): 489–499.
- Hubbard LR (1990) Clear Body, Clear Mind. 2002 ed. Los Angeles: Bridge Publications.
- Kilburn KH, Warsaw RH, and Shields MG (1989) Neurobehavioral dysfunction in firemen exposed to polychlorinated biphenyls (PCBs): possible improvement after detoxification. Archives of Environmental Health 44(6): 345–350.
- Leonard KL. (2008). Is patient satisfaction sensitive to changes in the quality of care? An exploitation of the Hawthorne effect. Journal of Health Economics 27(2): 444–59.
- Levisky JA, Bowerman DL, Jenkins WW, Johnson DG, and Karch SB (2001) Drugs in postmortem adipose tissues: evidence of antemortem deposition. Forensic Science International 121(3): 157–160.
- Marshall DR (2000) Report before the 106th congress: emerging drug threats and perils facing Utah’s youth. Salt Lake City, UT: Committee on the Judiciary, United States Senate. http://frwebgate.access.gpo.gov/cgi-bin/getdoc.cgi?dbname. 106_senate_ hearings&docid. f:73821.pdf (accessed 17 April 2011)
- Martyny JW, Arbuckle SL, McCammon CS, Esswein EJ, and Erb N (2004) Chemical exposures associated with clandestine methamphetamine laboratories. Denver, CO: National Jewish Medical and Research Center www.nationaljewish.org/pdf/chemical_ exposures.pdf. (accessed 17 April 2011).
- Martyny JW, Van Dyke MV, McCammon CS, Erb N, and Arbuckle SL (2005a) Chemical exposures associated with clandestine methamphetamine laboratories using the anhydrous ammonia method of production. Denver, CO: National Jewish Medical and Research Center. http://www.njc.org/pdf/Ammonia%20Meth.pdf. (accessed 17 April 2011).
- Martyny JW, Van Dyke M, McCammon CS, Erb N, Arbuckle SL (2005b) Chemical exposures associated with clandestine methamphetamine laboratories using the hypophosphorous and phosphorous flake method of production. National Jewish Medical Research Center http://www.njc.org/pdf/meth-hypo-cook.pdf (Accessed 9 Feb 2011).
- Miller MD, Crofton KM, Rice DC, and Zoeller RT (2009) Thyroid-disrupting chemicals: interpreting upstream biomarkers of adverse outcomes. Environmental Health Perspectives 117(7): 1033–1041.
- Rea WJ, Pan Y, Johnson AR, Ross GH, Suyama H, and Fenyves EJ (1996) Reduction of chemical sensitivity by means of heat depuration, physical therapy and nutritional supplementation. Journal of Nutritional and Environmental Medicine 6: 141–148.
- Schep LJ, Slaughter RJ, and Beasley DM (2010) The clinical toxicology of metamfetamine. Clinical Toxicology (Philadelphia) 48(7): 675–694.
- Schnare DW, Ben M, and Shields MG (1984) Body burden reduction of PCBs, PBBs and chlorinated pesticides in human subjects. Ambio 13: 378–380.
- Schnare DW, Denk G, Shields M, and Brunton S (1982) Evaluation of a detoxification regimen for fat stored xenobiotics. Medical Hypotheses 9(3): 265–282.
- Sharpe RM (2003) The “oestrogen hypothesis”—where do we stand now? International Journal of Andrology 26(1): 2–15.
- Singer R (2006) Neurotoxicity Guidebook. San Diego, CA: Aventine Press, 3.
- Witter RZ, Martyny JW, Mueller K, Gottschall B, and Newman LS (2007) Symptoms experienced by law enforcement personnel during methamphetamine lab investigations. Journal of Occupational and Environmental Hygiene 4(12): 895–902.
- Thrasher DL, Von Derau K, and Burgess J (2009) Health effects from reported exposure to methamphetamine labs: a poison center-based study. Journal of Medical Toxicology 5(4): 200–204.
- Tretjak Z, Beckmann S, Tretjak A, and Gunnerson C (1989) Report on occupational, environmental, and public health in Semic: a case study of polychlorinated biphenyl (PCB) pollution. In: Post-Audits of Environmental Programs and Projects; Proceedings, Environmental Impact Analysis Research Council / ASCE. New Orleans, LA, 57–72.
- Tretjak Z, Shields M, and Beckmann SL (1990) PCB reduction and clinical improvement by detoxification: an unexploited approach? Human and Experimental Toxicology 9(4): 235–244.
- Tsyb AF, Parshkov EM, Barnes J, Yarzutkin VV, Vorontsov NV, and Dedov VI (1998) Proceedings of the 1998 International Radiological Post Emergency Response Issues Conference. Washington, DC: US EPA, 162–166, efile pages 178–182.
- Witter RZ, Martyny JW, Mueller K, Gottschall B, and Newman LS (2007) Symptoms experienced by law enforcement personnel during methamphetamine lab investigations. Journal of Occupational and Environmental Hygiene 4(12): 895–902.
- Woodruff TJ (2011) Bridging epidemiology and model organisms to increase understanding of endocrine disrupting chemicals and human health effects. The Journal of Steroid Biochemistry and Molecular Biology 127(1–2): 108–117.
- Wu FC, Tajar A, Beynon JM, Pye SR, Silman AJ, Finn JD, et al. (2010) Identification of late-onset hypogonadism in middle-aged and elderly men. The New England Journal of Medicine 363(2): 123–135.

